Notícias
Covid-19: Anvisa reforça que não recebeu pedido de registro de vacina

Agência teve reuniões com laboratórios nesta quinta-feira
A Agência Nacional de Vigilância Sanitária (Anvisa) disse hoje (7) que ainda não recebeu nenhum pedido de uso emergencial ou de registro definitivo de vacinas para covid-19 no Brasil. A informação foi dada após nova reunião com técnicos da Fundação Oswaldo Cruz (Fiocruz) e do laboratório Astrazeneca e logo após a apresentação dos estudos clínicos sobre a eficácia da vacina CoronaVac, pelo Instituto Butantan.
“Até o momento, a Anvisa não recebeu nenhum pedido de uso emergencial ou de registro definitivo de vacinas para covid-19 no Brasil”, diz nota divulgada pela agência reguladora.
A reunião na manhã desta quinta-feira tratou de questões envolvendo a autorização emergencial do uso das doses da vacina contra a covid-19 , desenvolvida pela Astrazeneca em parceria com a Fiocruz. Segundo a Anvisa, a troca de informações é a continuidade das reuniões que ocorreram nos últimos dias.
“A Anvisa tem atendido todos os laboratórios que estão desenvolvendo vacinas a fim de orientar e esclarecer questões técnicas para a avaliação de vacinas”, diz a nota.
No dia 31 de dezembro de 2020, a Anvisa autorizou a importação, em caráter excepcional, de 2 milhões de doses da vacina britânica da Oxford, produzida em parceria com a Fiocruz no Brasil. As doses importadas são fabricadas pelo Serum Institute da Índia. No país asiático, o uso emergencial do imunizante já foi aprovado.
Com a chegada dos ingredientes farmacêuticos ativos (IFAs) importados em meados de janeiro, a Fundação Oswaldo Cruz prevê que a produção da vacina AstraZeneca/Oxford no Brasil deve começar no dia 20 deste mês. O imunizante previne contra a covid-19 e já começou a ser aplicado no Reino Unido.
A expectativa é que a Fiocruz apresente até amanhã (8) à Anvisa o pedido de uso emergencial dos 2 milhões de doses da vacina AstraZeneca/Oxford que o governo negocia para importar da Índia.
Butatan
Técnicos da Anvisa também se reuniram, nesta manhã, com representantes do Instituto Butantan, quando foram apresentados os estudos sobre a eficácia da vacina Coronavac, desenvolvida em parceria com o laboratório chinês Sinovac. De acordo com o Butantan, a vacina tem taxa de eficácia mínima de 78%.
De acordo com o diretor do Butantan, Dimas Covas, o governo paulista ainda não vai encaminhar o pedido de registro definitivo da vacina à Anvisa, já que isso teria que ser feito em conjunto com a Sinovac. O que será feito neste momento, segundo ele, será apenas o pedido de uso emergencial da vacina.
Por | Luciano Nascimento – Repórter da Agência Brasil – Brasília
Notícias
Trocar senhas por biometria de voz vale a pena?
Cada vez mais presente no dia a dia, a biometria de voz se consolida como uma alternativa segura e prática para autenticar usuários e garantir a proteção de dados

A tecnologia avança em ritmo acelerado e, com ela, surgem novas formas de tornar o cotidiano mais seguro e simples. Um desses avanços é a biometria de voz, recurso que vem ganhando destaque em empresas e instituições que buscam reduzir riscos e facilitar o acesso a serviços.
Você também pode gostar: Empresa de segurança digital lança proteção inteligente
Substituir as tradicionais senhas por comandos de voz já é uma realidade em setores como financeiro, telecomunicações e, mais recentemente, na saúde.
A ascensão dessa solução é impulsionada por dois fatores principais: a necessidade crescente de proteger informações sensíveis e o desejo por experiências mais ágeis e descomplicadas. Com dispositivos cada vez mais integrados à nossa rotina, o reconhecimento vocal surge como uma resposta eficiente e segura para essas demandas.
Por que a biometria de voz está ganhando espaço nas empresas?
A busca por métodos de autenticação mais seguros e práticos nunca foi tão intensa. Com o aumento das ameaças digitais, senhas convencionais passaram a ser vistas como frágeis e vulneráveis a ataques. Nesse cenário, a biometria de voz desponta como uma solução capaz de unir segurança e conveniência.
Empresas de diversos segmentos já enxergam valor na tecnologia. Call centers, por exemplo, usam o recurso para validar rapidamente a identidade dos clientes, reduzindo o tempo de atendimento. Instituições financeiras também adotaram a solução para minimizar fraudes e garantir transações mais seguras. Até mesmo o varejo explora a biometria vocal para personalizar experiências e agilizar processos de compra.
Além de garantir proteção, a biometria de voz contribui para melhorar a percepção do consumidor, que passa a ter interações mais fluidas e menos burocráticas com as marcas.
Benefícios da substituição de senhas pela biometria vocal
O reconhecimento por voz vai além da segurança. Ele oferece vantagens que impactam diretamente na experiência dos usuários e na eficiência das operações.
Mais praticidade no dia a dia
Esquecer senhas é um problema comum e fonte constante de frustração. A biometria de voz elimina essa barreira. Com ela, basta falar para ter acesso a serviços, autorizar pagamentos ou validar identidades. Essa simplicidade torna as interações mais rápidas e reduz a necessidade de suporte técnico.
Outro ponto positivo é a acessibilidade. Pessoas com dificuldades motoras ou visuais se beneficiam do uso da voz como ferramenta de autenticação, o que torna a tecnologia inclusiva e adaptável a diferentes perfis.
Redução de fraudes e invasões
Cada voz é única, com características específicas que tornam a falsificação extremamente difícil. Diferente de senhas que podem ser compartilhadas ou descobertas, a biometria vocal oferece um nível superior de proteção.
Empresas que adotam a tecnologia relatam quedas significativas em tentativas de fraude. Como o reconhecimento de voz analisa aspectos como tom, velocidade e frequência, até mesmo gravações ou imitações têm pouca chance de burlar o sistema.
Aplicações em diferentes áreas
A versatilidade é outro grande atrativo. A biometria de voz não se limita a ambientes corporativos. Ela já é usada em dispositivos domésticos, serviços bancários, no setor de telecomunicações e, com destaque especial, na área da saúde.
Hospitais e clínicas começaram a explorar o recurso para otimizar atendimentos e proteger informações sensíveis. Pacientes podem ser identificados rapidamente, profissionais acessam prontuários de forma segura e processos burocráticos são simplificados.
Já usamos biometria de voz e nem sabemos?
Muita gente nem percebe, mas já usa biometria de voz no dia a dia. Assistentes virtuais como a Siri, da Apple, e o Google Assistente reconhecem a voz do usuário para oferecer respostas personalizadas e garantir mais segurança.
A Siri, por exemplo, só ativa certas funções quando identifica a voz do dono do aparelho. O mesmo acontece com o “Ok Google”, que aprende o jeito de falar de cada pessoa para evitar comandos acidentais.
Estes sistemas mostram como a tecnologia de reconhecimento de voz já está presente de forma natural na rotina.
A voz como chave de acesso
A biometria de voz é mais do que uma tendência tecnológica. Ela representa uma mudança na forma como lidamos com a segurança e a experiência do usuário. Substituir senhas por esse recurso é apostar em um futuro mais prático e protegido.
Além de aumentar a segurança e facilitar o acesso, a biometria de voz vem ganhando espaço em setores como o da saúde, com soluções de reconhecimento de voz médico que agilizam atendimentos, protegem dados pessoais e elevam a experiência dos pacientes a outro nível.
Com os avanços contínuos na área e a aceitação crescente por parte dos consumidores, tudo indica que ouvir será, cada vez mais, a chave para garantir segurança e simplicidade no dia a dia.
Por | Giovanna Angeli – SEO Marketing
Notícias
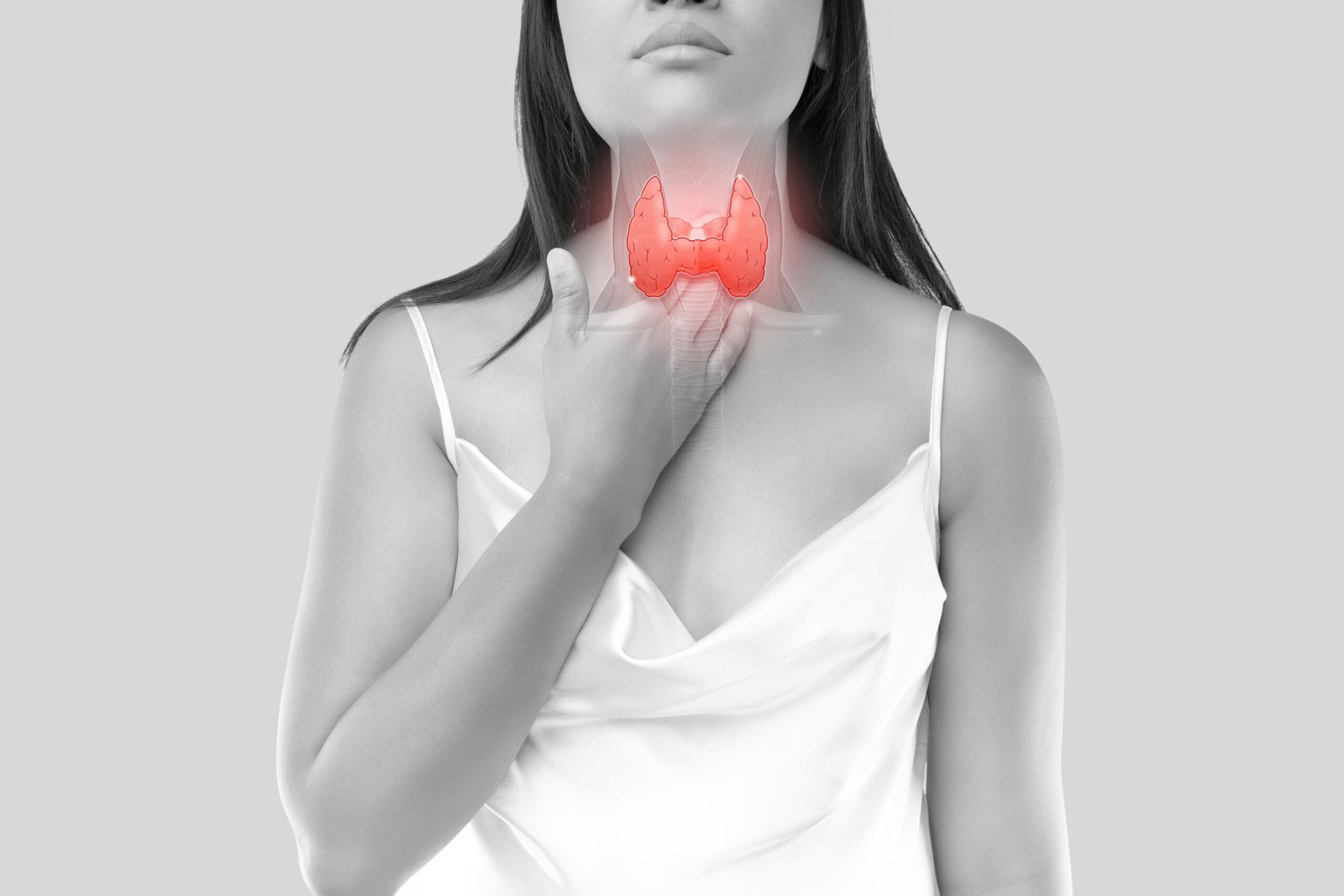
Tireoide: médica explica sobre nódulos, riscos e tratamentos
Alterações na tireoide, mesmo aquelas com sintomas leves, podem afetar significativamente a qualidade de vida e a saúde da pessoa, adverte a médica Olivia Grimaldi. A falta de diagnóstico e de tratamento leva a complicações graves no futuro
27/3/2025 –
Alterações na tireoide, mesmo aquelas com sintomas leves, podem afetar significativamente a qualidade de vida e a saúde da pessoa, adverte a médica Olivia Grimaldi. A falta de diagnóstico e de tratamento leva a complicações graves no futuro
A Organização Mundial da Saúde (OMS) estima que 750 milhões de pessoas no mundo sofram de alguma patologia relacionada à tireoide, sendo que cerca de 60% sequer sabe da sua própria condição. Essa glândula, uma das maiores do corpo, produz hormônios e regula funções de órgãos como coração, rins, cérebro e fígado, como explica o Ministério da Saúde.
Olivia Grimaldi, médica patologista especializada em doenças de tireoide, afirma que a estimativa da OMS é preocupante por diversas razões. Uma delas é o fato de que alterações na tireoide, mesmo as subclínicas (com sintomas leves), podem afetar significativamente a qualidade de vida, o metabolismo, a saúde cardiovascular, a função cognitiva e o bem-estar emocional da pessoa.
Além disso, a falta de diagnóstico e de tratamento, em determinados casos, leva a complicações graves no futuro, já que os sintomas são inespecíficos e passíveis de serem confundidos com outras condições.
Um exemplo de complicação é o hipotireoidismo, caracterizado pela baixa produção dos hormônios T3 e T4. “Pode resultar em mixedema (inchaço da pele e dos tecidos moles como gordura e músculos, uma condição rara, mas potencialmente fatal), problemas cardíacos, infertilidade e comprometimento do desenvolvimento neurológico em bebês de mães não tratadas”, ressalta Dra. Olivia Grimaldi.
Outra preocupação é o hipertireoidismo, quando há a produção dos hormônios acima do que o corpo precisa. A pessoa pode sofrer com arritmias cardíacas, osteoporose e crise tireotóxica (“tempestade tireoidiana”, quando os hormônios tireoidianos são liberados no sangue em altíssima quantidade), considerada uma emergência médica.
“Gestantes e mulheres em idade fértil são particularmente vulneráveis, pois as alterações na função tireoidiana têm a possibilidade de afetar a fertilidade, a gravidez e o desenvolvimento fetal”, explica a médica.
A fadiga, a depressão e outros sintomas associados às doenças da tireoide podem afetar a capacidade de trabalho e a produtividade, prejudicando a qualidade de vida e o bem-estar emocional do indivíduo, salienta Dra. Olivia Grimaldi.
Nódulos
Um nódulo na tireoide é o resultado de crescimento anormal de células dentro da glândula, com a formação de uma pequena massa ou caroço.
“A grande maioria dos nódulos é benigna, mas sinalizam desequilíbrios no organismo – desde fatores hormonais até deficiências nutricionais, intoxicações, obesidade, síndrome metabólica. Olhar para as causas resolve a questão e previne nódulos em outros órgãos. Por exemplo, quantas mulheres têm nódulos na mama e tireoide? Será que não estão relacionados?”, diz.
Apesar de a maioria dos nódulos ser benigna, uma pequena porcentagem é cancerosa. “Características como crescimento rápido, consistência dura, fixação a tecidos adjacentes, rouquidão ou linfonodos aumentados no pescoço levantam suspeitas”, adverte.
Há ainda os nódulos autônomos, que produzem hormônios tireoidianos independentemente do controle do hormônio tireoestimulante (TSH). Eles são uma das causas do hipertireoidismo, com risco de complicações cardíacas e ósseas.
Nódulos grandes também podem comprimir estruturas adjacentes, como a traqueia ou o esôfago, causando dificuldade para respirar ou engolir, salienta Dra. Olivia Grimaldi.
“A punção aspirativa com agulha fina é o método de escolha para definir a urgência do tratamento. Enquanto a ultrassonografia avalia as características do nódulo, a punção é recomendada para aqueles com características suspeitas ou maiores que 1 centímetro”, esclarece.
Os resultados da punção após análise do material no microscópio são classificados de acordo com o sistema de Bethesda, que funciona como uma escala de malignidade – ou seja, fornece uma estimativa do risco e orienta as decisões de acompanhamento ou tratamento imediato.
Tratamentos para nódulos na tireoide
Dra. Olivia Grimaldi diz que o tratamento das doenças da tireoide deve ser individualizado, levando em consideração os sintomas do paciente, os resultados dos exames laboratoriais e a presença de outras condições de saúde.
No caso do tratamento clínico, o médico investiga e aborda cada um dos fatores envolvidos na formação do nódulo, como deficiência nutricional, intoxicação ambiental, desequilíbrios hormonais, síndrome metabólica, resistência insulínica e inflamação (doença de Hashimoto, por exemplo), afirma.
Segundo a médica, o iodo radioativo, medicamento à base de iodo que emite radiação, é usado para nódulos hiperfuncionantes que causam hipertireoidismo, mas atualmente pode ser substituído pela ablação para preservar a função da glândula ‒ desde que sob supervisão médica.
“A ablação por radiofrequência ou microondas é um procedimento minimamente invasivo para reduzir o tamanho de nódulos benignos sintomáticos. Também indicada para nódulos malignos de até 1 centímetro, a depender das características ultrassonográficas”, esclarece a médica.
“A cirurgia de remoção da tireoide, chamada de tireoidectomia, é indicada para nódulos malignos, grandes que causam compressão ou com suspeita de malignidade que não podem ser esclarecidos por biópsia”, complementa.
Cuidados no dia a dia
Uma pessoa diagnosticada com doença na tireoide deve tomar no dia a dia alguns cuidados, orienta Dra. Olivia Grimaldi. Primeiramente, deve seguir a medicação prescrita pelo médico e manter uma dieta equilibrada, evitando excesso de iodo (especialmente em casos de Hashimoto) e garantindo a ingestão adequada de selênio, zinco e ferro.
“O acompanhamento médico regular é fundamental. Isto é, realizar exames de sangue periódicos para monitorar a função tireoidiana e ajustar a dose da medicação, suplementação e dieta, se necessário, sempre com acompanhamento profissional”, diz a médica.
Em relação ao estilo de vida, o paciente deve gerenciar o estresse, um dos fatores que afetam a função imunológica e tireoidiana. “Praticar atividade física regularmente ajuda a melhorar o metabolismo e o bem-estar geral. Recomendo a realização de exercícios após recuperar a disposição”, pondera.
“A pessoa não pode esquecer de informar ao médico sobre todos os medicamentos e suplementos que está tomando, pois alguns podem interferir na absorção ou metabolismo dos hormônios tireoidianos”, recomenda Dra. Olivia Grimaldi.
Para mais informações, basta acessar: https://draoliviagrimaldi.com.br/
Notícias
Pesquisa da Eitri aponta que 64% dos apps decepcionam usuários
Empresa que ajuda a desenvolver apps de forma escalável e personalizada analisou mais de 200 mil aplicativos disponíveis no mercado e apenas 18% deles atingiram excelência em qualidade
27/3/2025 –
Empresa que ajuda a desenvolver apps de forma escalável e personalizada analisou mais de 200 mil aplicativos disponíveis no mercado e apenas 18% deles atingiram excelência em qualidade
Os apps estão se tornando cada vez mais integrados ao cotidiano das pessoas, seja para realizar compras, estudar ou fazer amigos. Entretanto, a ampla disponibilidade não garante satisfação dos users. Uma pesquisa interna da Eitri, utilizando dados de revisões e avaliações dos usuários de mais de 200 mil aplicativos em geral, incluindo apps de e-commerce, revelou informações significativas: 64% desapontam os usuários, enquanto apenas 18% atingem excelência em qualidade; aplicações de shopping lideram em excelência.
Vale destacar que, dos 205.230 apps analisados, 131.799 não possuíam avaliações suficientes para uma classificação precisa. As categorias com maior percentual de excelência são Livros e Referências (33,72%), Clima (29,60%) e Compras (29,43%). Em contrapartida, enfrentam maiores desafios em relação à satisfação dos users: Jogos de Corrida (4,94%), Jogos Educacionais (4,75%) e Dating (2,16%).
Pontos fortes e fracos dos apps
Os clientes destacam como aspectos positivos a experiência de compra quando tudo funciona corretamente (18%), a conveniência como alternativa às lojas físicas (11%), a facilidade de uso (10,3%) e a qualidade dos produtos (9%). Isso demonstra que eles apreciam, sobretudo, uma jornada que seja fácil, conveniente e ofereça bons produtos.
Entre os principais pontos fracos foram apontados a instabilidade e o desempenho insatisfatório dos apps (15%), seguidos por problemas no processo de compra (13%), falhas relacionadas a cupons e descontos (9%) e inconsistências nos fretes (6%). Essas questões técnicas e funcionais impactam negativamente, representando barreiras para a retenção de users em ambientes de e-commerce.
O que os usuários mais valorizam?
Aplicações que permitem encontrar produtos e concluir compras de forma rápida e sem complicações são valorizadas pelos usuários, que tendem a separar a qualidade dos itens da experiência com o aplicativo, indicando que a marca é apreciada independentemente do canal de venda. Quando os apps funcionam conforme o esperado, a eficiência logística se destaca como diferencial importante. Além disso, economia e oportunidades de desconto são fatores relevantes na decisão de comprar um produto.
A amplitude do catálogo também é um aspecto apreciado, assim como um bom suporte, que contribua para a fidelização dos clientes. O canal digital é percebido como alternativa relevante às lojas físicas, e a flexibilidade nas opções de finalização do pedido é valorizada. Por fim, o aplicativo é visto como extensão da experiência geral com a marca, reforçando a importância de uma plataforma eficiente e bem estruturada.
“Nossa pesquisa revelou que o mercado de apps de qualidade permanece amplamente inexplorado, apresentando uma clara distinção entre aplicações bem desenvolvidas e as que são ruins. Essa diferenciação não apenas destaca a necessidade de inovação e excelência no setor, mas também evidencia que apps bem avaliados tendem a obter maior visibilidade nas lojas de aplicativos, influenciando diretamente as decisões dos usuários”, afirma Guilherme Martins, cofundador da Eitri.
-

 Regional4 dias ago
Regional4 dias agoFrente fria, riscos em alta: como o clima impacta a saúde dos pets
-

 Poços de Caldas3 dias ago
Poços de Caldas3 dias agoPrefeitura de Poços abre o Junho Verde nesta segunda-feira (2)
-

 Notícias Corporativas4 dias ago
Notícias Corporativas4 dias agoApps que conectam marcas e consumidores se destacam no marketing digital
-
Notícias Corporativas4 dias ago
Marcado leilão da Imcopa com valor mínimo de R$ 1,7 bilhão
-

 Notícias Corporativas4 dias ago
Notícias Corporativas4 dias agoGestão de conta de energia evita desperdício e gera economia
-

 Notícias Corporativas3 dias ago
Notícias Corporativas3 dias agoCosméticos falsificados ameaçam a saúde capilar
-

 Notícias Corporativas4 dias ago
Notícias Corporativas4 dias agoBrindes corporativos fortalecem estratégias de engajamento e fidelização
-
 Notícias Corporativas3 dias ago
Notícias Corporativas3 dias agoGarín entra na disputa por mercado de gestão de patrimônio











